1) Inventaires taxonomiques, descriptions de nouvelles espèces, et phylogénies
Grâce à un effort d'échantillonnage remarquable, ciblé sur des groupes d'espèces encore sous-étudiés et dans des environnements sous-échantillonnés, et grâce à une approche intégrative alliant analyses morphologiques et génétiques, nous avons déjà pu mettre en évidence un grand nombre d'espèces nouvelles pour la science (14 nouvelles espèces décrites à ce jour), et beaucoup sont encore en cours de description. Parmi les nouvelles espèces déjà décrites, nous pouvons citer six nouvelles espèces d'algues brunes du genre Lobophora (Viera et al. 2020a, 2020b), ainsi qu'un grand nombre d'espèces d'éponges issues de plusieurs classes (Ruiz et al. 2017, Pérez & Ruiz 2018, Lopes et al. 2018, Fontana et al. 2018, Grenier et al. 2020). Certains échantillons ont même conduit à la description de nouveaux genres, comme le genre Bidderia dans la classe des Calcarea (Lopes et al. 2018) qui a été décrit dans les îles françaises de Saint Martin et de la Guadeloupe (Figure 2B) ou le genre Aspiculophora de la classe des Homoscleromorpha (Ruiz et al. 2017), décrit en Martinique, en Guadeloupe et à Saint Martin.

Figure 2: Exemples (photographie sous-marines) de nouvelles espèces éponges découvertes dans les Antilles et décrites à partir du matériel collecté pendant la campagne PACOTILLES. A - Ernstia adunca sp. nov. (Calcarea), Le Rocher du Diamant, Martinique (Fontana et al. 2018) ; B - Bidderia bicolora gen. nov. sp. nov. (Calcarea), Circus-Tintamare, Saint Martin (Lopes et al. 2018), C - Oscarella filipoi sp. nov. (Homoscleromorpha), Anses d'Arlet, Martinique (Pérez & Ruiz 2017) ; D- Oscarella filipoi sp. nov. (Homoscleromorpha) Le Rocher du Diamant, Martinique (Pérez & Ruiz 2017).
Les échantillons d'éponges de la classe des Calcarea récoltés (656 spécimens issus de 10 sites) et analysés par une approche de taxonomie intégrative alliant analyses morphologiques et génétiques ont permis de réaliser un premier inventaire. Sur les 485 spécimens déjà analysés, et nous avons trouvé jusqu'à présent 40 espèces (8 genres) de Calcinea et 12 espèces (6 genres) de Calcaronea. Une variabilité significative de l'abondance de Calcarea et de la richesse des espèces à l'échelle des Petites Antilles est enregistrée, mais ces observations restent à mettre en relation avec l'effort d'échantillonnage déployé dans chaque île. Les échantillons collectés en Martinique ont spécifiquement fait l'objet d'un article mettant en évidence 11 espèces issues de six genres, dont trois espèces sont nouvelles pour la science (Fontana et al. 2018): Borojevia crystallina sp. nov., Clathrina delicata sp. nov., and Ernstia adunca sp. nov. (Figure 2A).
Environ la moitié des éponges collectées lors de la campagne PACOTILLES appartiennent à la classe des Demospongiae qui sont de loin les plus abondantes et la classe des Porifera la plus connue. L'étude taxonomique de cette classe est possible grâce à la coordination des différentes expertises disponibles au sein du LIA MARRIO, et elle implique parfois aussi des collaborateurs externes. Aujourd'hui, près de 75% de ces échantillons ont subi un premier traitement, le reste de la collection faisant actuellement l'objet d'une identification rapide au niveau du genre ou de la Famille, afin de les distribuer à nos collaborateurs. Outre sa contribution significative à l'inventaire de la faune des spongiaires des Caraïbes, ce matériel sert également les questions de systématique, de cosmopolitisme, de connectivité à l'échelle de la Grande Caraïbe ou encore de l'Atlantique tropical occidental et de chimie des produits naturels.
Pour les coraux, le nombre d'espèces enregistrées au cours de la campagne est de 53 (48 Scléractiniaires et 5 Hydrocoralliaires). Sur l'ensemble de la région Caraïbe, 116 espèces sont connues. La richesse spécifique entre les sites varie de 9 espèces, pour un lagon très dégradé, à 30, pour des zones récifales en bon état. La richesse moyenne, estimée à 23 ± 3,4 espèces par site, est relativement élevée pour la région des Caraïbes. Siderastrea siderea, Porites astreoides, ainsi que Hydrocorallaria Millepora alcicornis sont des espèces considérées ubiquistes puisqu'elles sont présentes dans plus de 97 des stations étudiées. Ce sont des espèces naturellement très résistantes à l'altération de leur environnement et, par conséquent, leur importance quantitative s'est accrue sur les récifs des Caraïbes au cours des dernières décennies à mesure qu'ils se détériorent. A l'inverse, certaines espèces autrefois communes dans les Petites Antilles sont raréfiées. Il s'agit, de manière spectaculaire, de l'acropore Acropora cerviconis qui n'existe que dans quelques sites. De même, dans la famille des Mussidae, les espèces appartenant au genre Mycetophyllia se font de plus en plus rares.
Chez certains taxons, notamment les éponges de la classe des Homoscleromorpha, celles de la famille des Verongimorpha (classe des Desmosponges) et les algues vertes de la famille des Udoteaceae, la découverte de ces nouvelles espèces ou lignées a bouleversé la systématique du groupe (Ruiz et al. 2017, Lagourgue et al. 2018), appelant à des révisions taxonomiques. Cependant, plus généralement, les échantillons récoltés ont permis de compléter les phylogénies grâce aux séquences des taxons pour lesquels aucune donnée génétique n'était disponible avant cette étude, et les phylogéographies pour d'autres espèces pour lesquelles nous avons des échantillons provenant de sites alentours.
2) L'arc antillais : un hotspot de biodiversité marine dans l'Atlantique Nord?
Chez les algues brunes du genre Lobophora (illustration Fig.3A-I), nos résultats ont mis en évidence que la région Caraïbe se distingue comme un point chaud de diversité dans l'océan Atlantique Nord. De façon remarquable, la Caraïbe orientale, dans laquelle se situe l'Arc Antillais, s'est avérée être l'écorégion la plus diversifiée de la Grande Caraïbe, avec 16 espèces sur les 19 espèces recensées dans l'Atlantique (Fig. 3J). Sur ces 16 espèces, 11 se trouvent exclusivement dans la Grande Caraïbe. Les analyses biogéographiques montrent que la Grande Caraïbe a été une région réceptrice pour les espèces de Lobophora de l'Indo-Pacifique et une région de diversification, ainsi qu'une région exportatrice pour l'Atlantique du Nord-Est. Les résultats montrent que la Grande Caraïbe peut donc génèrer et exporter de la diversité.

Figure 3: Photographies sous-marines de quelques espèces de Lobophora rencontrées au cours de la mission PACOTILLES: Lobophora canariensis from Saint Lucia, voucher CP15460 (A); L. declerckii from Saint Lucia, voucher CP15434 (B); L. dickiei sp. nov. from Martinique, voucher CP15086 (C); L. guadeloupensis from Curaçao, voucher CWV0822 (D); L. lamourouxii sp. nov. from Saint Vincent, voucher CP15164 (E); L. richardii sp. nov. from Martinique, voucher CP15127 (F); L. variegata from Saint Martin, voucher CP15730 (G); L. colombiana from Bequia, voucher CP15268 (H); and L. setchellii sp. nov. from Saint Vincent, voucher CP15174 (I). Carte représentant la diversité des espèces de Lobophora par province (J) avec le nombre d'espèces enregistrées par province sur les 18 espèces de Lobophora identifiées dans la région Caraïbe (Viera et al. 2020a).
Les résultats issus des échantillons d'algue verte de la famille Udotecea sont remarquablement similaires (Lagourgue et al. 2018). Les résultats de la délimitation des espèces à partir des données génétiques ont mis en évidence, dans l'ensemble de la Caraïbe, 18 espèces putatives parmi lesquelles 15 ont pu avoir un nom attribué à partir des observations morpho-anatomiques (Figure 4). Ces 15 taxons appartiennent aux genres Udotea (8 espèces), Penicillus (4), Rhipocephalus (2), et Rhipidosiphon (1). Une espèce peut être nouvelle pour la science est suspectée, car ses caractères morpho-anatomiques ne correspondent à aucune des espèces connues, mais nous recommandons la révision et la redéfinition préalables du genre Udotea avant que cette espèce puisse être décrite avec certitude. Parmi toutes les espèces, 16 étaient présentes dans les Petites Antilles, soulignant ainsi la diversité de cette sous-région.
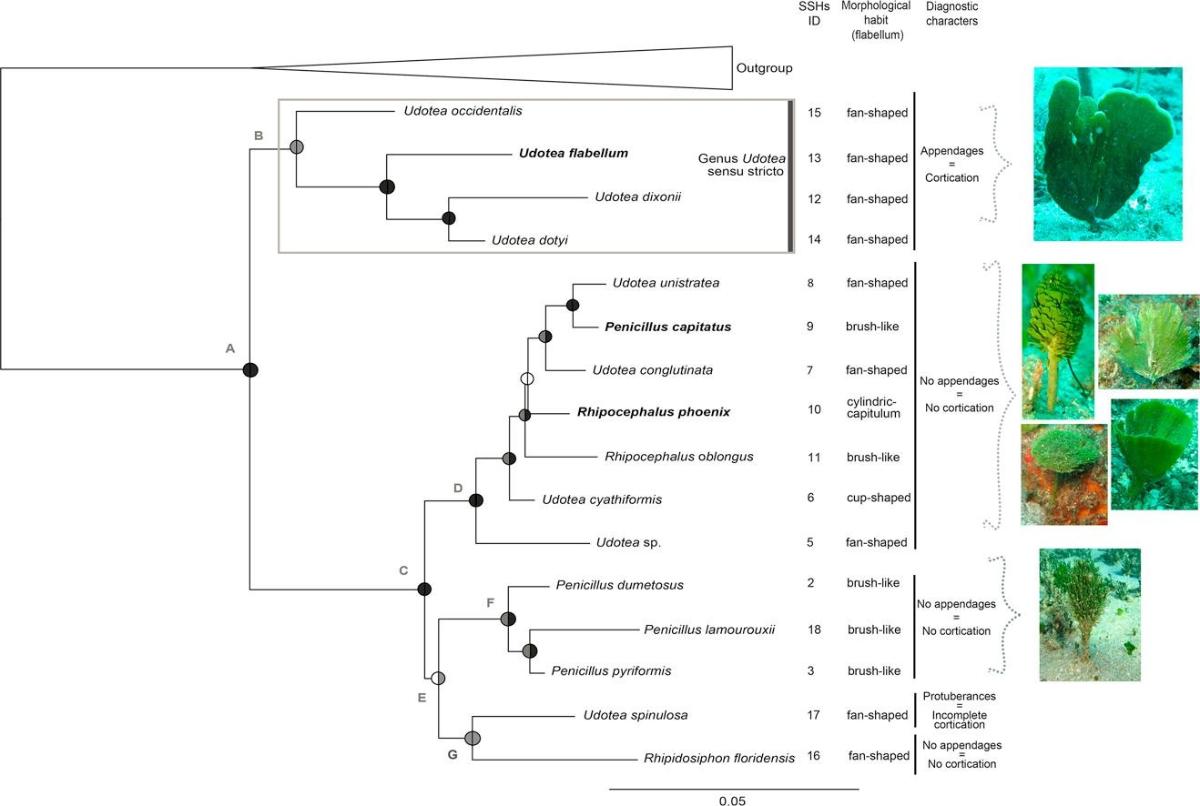
Figure 4: Arbre phylogénétique issues des séquences des échantillons l'Udoteceae récoltés au cours de la mission PACOTILLES. À chaque n?ud, les cercles représentent les valeurs du bootstrap ML (à gauche) et les probabilités postérieures bayésiennes (à droite) : un cercle noir indique un fort support (bs > 95; PP > 0.98), un cercle gris représente un support modéré (95 > bs > 60; 0.98 > PP > 0.70), et un cercle blanc indique l'absence de support (bs < 60 and PP < 0.70). L'ID du nombre d'espèces putatives (SSH, selon l'analyse de délimitation des espèces), le port morphologique et les caractères diagnostiques sont indiqués dans les colonnes de droite (Lagourgue et al. 2018).
Plus généralement, à l'échelle de l'arc Antillais, les inventaires taxonomiques dans les groupes que nous avons étudiés ont mis en évidence qu'en dépit de sa localisation périphérique dans la région caribéenne, l'arc antillais révèle une très forte diversité spécifique (voir les exemples précédemment cités, avec le plus grand nombre d'espèce enregistré pour le bassin Caribéen présentes dans l'Arc Antillais). Après les travaux réalisés sur les éponges, La Martinique se singularise particulièrement comme un hotspot peu égalé à l'échelle de la Caraïbe (Pérez et al. 2017).
Ces résultats s'expliquent partiellement par l'inclusion des données génétiques dans ces inventaires, ayant permis l'identification de plusieurs espèces cryptiques. Notre étude souligne donc l'importance d'utiliser des approches taxonomiques moléculaires pour évaluer avec précision les niveaux de diversité spécifique et d'endémisme, particulièrement dans les régions périphériques insulaires qui agissent comme des incubateurs évolutifs. Elle souligne également qu'un échantillonnage basé sur des identification moléculaires bouleverse les patrons biogéographiques que nous connaissions.
3) Diversité génétique et connectivité à l'échelle de l'Arc Antillais
Les échantillons populationnels collectés pour les analyses de connectivité ont mis en évidence des patrons similaire pour les trois espèces pour lesquelles les données sont déjà disponibles, avec cependant des niveaux de différentiation génétique différents en fonction des espèces. Pour les trois espèces (les coraux Acropora palmata et Porites astreoides, et l'éponge Ircinia campana), nous avons observé une relation significative entre les distances génétiques et les distances géographiques entre sites d'études (Figure 5). Ce schéma d'isolement par la distance peut s'expliquer par une dispersion larvaire limitée par la distance géographique combinée au contexte géographique spécifique de l'archipel des Petites Antilles, c'est-à-dire de petites îles plus ou moins régulièrement espacées les unes des autres de quelques kilomètres et alignées selon un axe nord-sud.
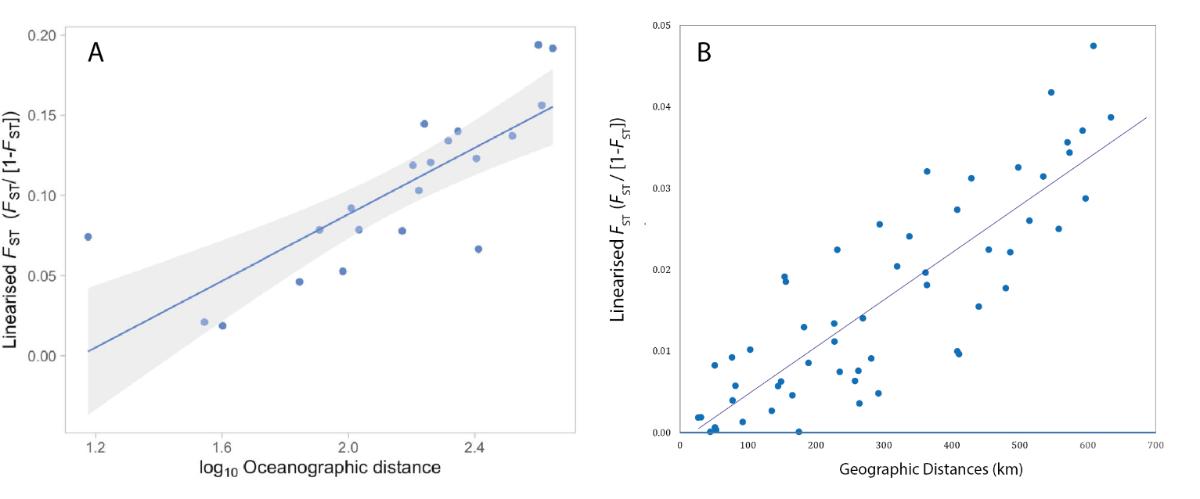
Figure 5 : Relation entre les distances génétiques (Fst standardisé) et les distances géographiques entre sites le long de l'Arc Antillais pour Ircina campana (A) et Acropora palmata (B)
Pourtant, des différences de patrons existent entre espèces, principalement liés au mode de reproduction de l'espèce et aux capacités dispersive des larves, la dispersion larvaire étant le seul moyen pour ces espèces fixées d'assurer une connectivité entre populations locales. Chez l'espèce Acropora palmata, espèce en danger d'extinction dans toute la région Caraïbe, l'analyse de la structure génétique a mis en évidence une structuration relativement faible mais significative à l'échelle de l'arc Antillais, avec des populations locales non génétiquement différenciées entre certaines iles proches (Figure 6). Les analyses d'autocorrélation spatiale ont révélé une dispersion larvaire limitée à moins de 1km, avec une direction du flux génétique principalement orienté vers le nord, en accord avec les courants de surface de l'océan dans la région. Ces résultats suggèrent que les populations les plus méridionales sont des sources potentielles de larves pour les îles les plus septentrionales et jouent un rôle clé dans le réensemencement des populations d'A. palmata des Petites Antilles (Japaud et al. 2019).
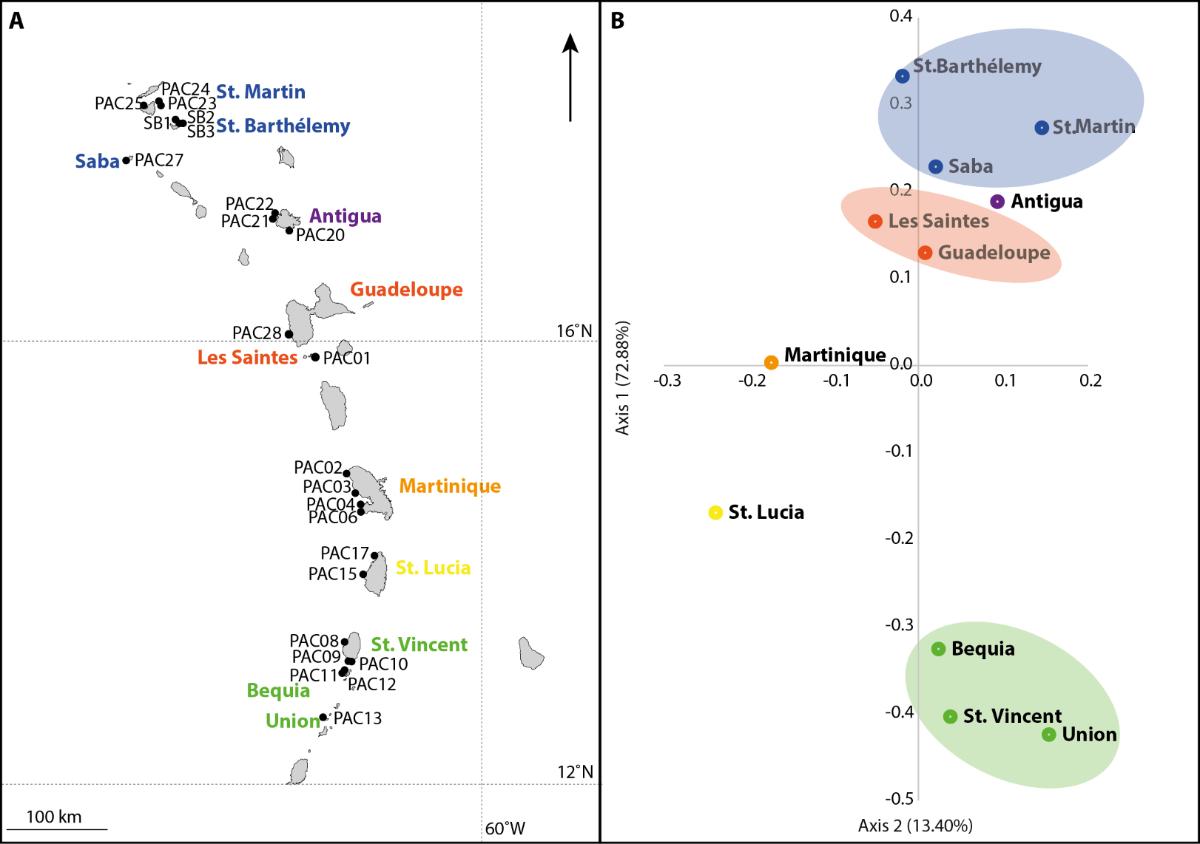
Figure 6 : Structure génétique des populations du corail Acropora palmata et leur répartition géographique dans l'arc antillais A : Carte de la zone d'étude avec les sites échantillonnés pendant la campagne PACOTILLES indiqués par un label « PAC »; B : Analyse des coordonnées principales (PCoA) basée sur les similitudes génétiques entre populations échantillonnées à l'aide de 13 loci microsatellites. Les populations partageant la même couleur (c'est-à-dire le bleu ou orange ou vert) ne se sont pas révélées génétiquement différenciées.
En revanche, pour l'éponge I. campana, une structuration génétique significativement plus forte a été observée entre les sites échantillonnés sur la même zone d'étude (FST allant de 0,015 à 0,143 entre les sites les plus éloignés, la Guadeloupe et Mayreau) et, contrairement à A. palmata, quatre clusters génétiquement différenciés ont été observés à l'échelle de l'Arc Antillais (Figure 7), correspondant aux quatre îles/zones échantillonnées : (i) la Guadeloupe, (ii) la Martinique, (iii) Sainte-Lucie et (iv) Saint-Vincent-et-les-Grenadines (Griffiths et al. 2020). Cette forte structuration génétique suggère une dispersion très limitée, comme on peut s'y attendre avec les éponges vivipares : bien que la durée de vie des larves pélagiques d' Ircina campana soit inconnue, elle varie généralement de quelques heures à quelques jours dans les éponges. La comparaison de ces deux études permet de mettre en évidence une dispersion larvaire plus limitée pour I. campana comparée à A. palmata. Une étude en cours de finalisation de l'éponge ovipare Clathrina aurea pourrait apporter des informations complémentaires (Condor-Lujan, soumis).

Figure 7 : Structure génétique des populations de l'éponge Ircinia campana. Chaque barre représente un individu ; les couleurs représentent l'appartenance un un cluster génétique, et les hauteurs des barres représentent les proportions d'appartenance à chaque cluster. L'analyse a d'abord été effectuée sur tous les sites, montrant K=4 groupes génétiques (a) ; des analyses séparées ont ensuite été effectuées sur les groupes multisites qui y ont été identifiés (b, c), montrant K=4 (b) et K=2 (c) groupes génétiques (Griffith et al. 2020a)
Les échantillons du corail Porites astreoides ont également été analysés à l'aide de marqueurs microsatellites (Riquet et al. soumis) mais ils sont actuellement réanalysés via une approche génomique RadSeq. Les premières analyses semblent mettre en évidence des lignées génétiques cryptiques vivant en sympatrie. Ces analyses génétiques seront accompagnées d'analyses morphométriques planifiées pour le début de 2021.